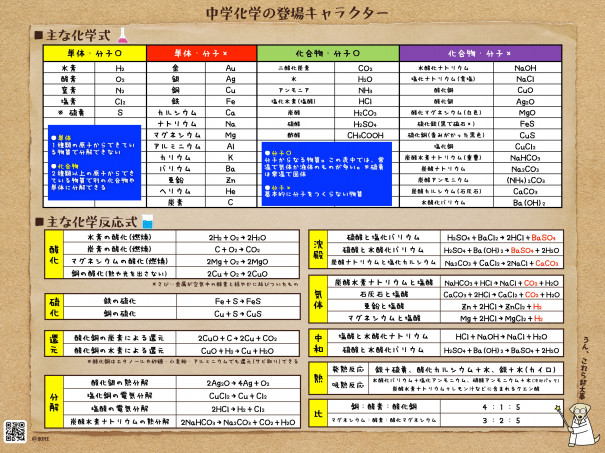
中和(定義・塩・中和反応式の作り方など) 酸化物の反応(金属元素・非金属元素) 酸性塩・塩基性塩・正塩(違い・見分け方・一覧など) 塩の液性(見分け方・演習問題など) 強酸・弱酸・強塩基・弱塩基(違い・覚え方・一覧など) 弱酸・弱塩基遊離反応原理や公式、反応式の作り�0410 · 高校の化学についてです。 組成式の一覧表みたいなのがあるサイトがあったら教えてください (><) 出来れば次の物質の組成式を教えてくれるとありがたいです・・・ ・塩化ナトリウム ・硝酸ナトリウム ・水酸化バリウム ・炭酸ナトリウム ・炭酸水素ナトリウム ・硫酸バリウム ・酸化カルシウム ・塩化マグネシウム ・酸化マグネシウム ・酸化銅(Ⅰ物質によっては,構成粒子の数が決まっていないものがあります。 その場合は,構成粒子の数を最も簡単な整数比で表す「組成式」が用いられます。 化学基礎で結晶の種類を4つ学習しますが,イオン結晶,共有結晶,金属結晶は組成式で表されます。 分子結晶のみ,組成式ではなく分子式が用いられます。 スポンサーリンク

1 2 1 イオン結晶と組成式 化学基礎 Youtube
組成式 一覧 高校
組成式 一覧 高校-組成式の書き方は、①陽イオン→陰イオン、②イオンの数の比、③比を右下に書く (1)は、Ca 2 ,Cl です。 まずは、陽イオン→陰イオンの順に並べます。「化学 イオン」,「理科 組成式、分子式、イオン式」,「物質量・濃度・化学反応式の計算演習LaTeXノート」,「化学基礎 組成式」,「高校化学基礎(イオン結合〜金属結合)」,「イオン結合」,「化学基礎3化学結合」,「化学基礎化学式
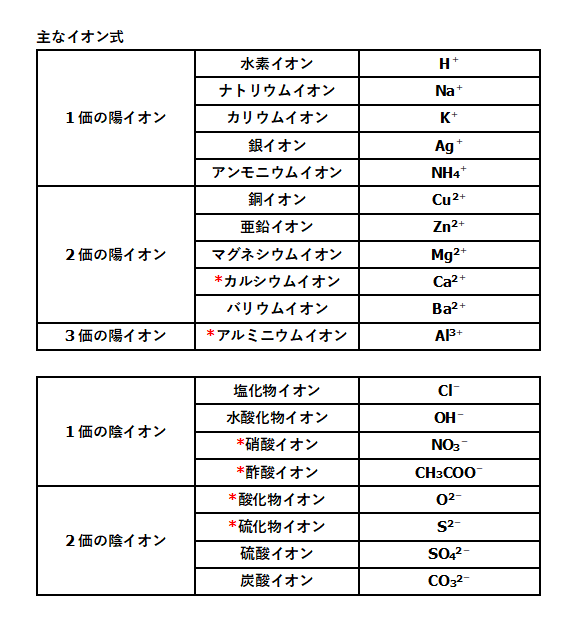



イオン式 電離式まとめ 中学理科 ポイントまとめと整理
精選版 日本国語大辞典 組成式の用語解説 〘名〙 化学式の一つ。実験式のことで、分子を構成する原子の種類と、各原子の数の比を示したもの。水を h2o と示す類。一般に用語として、実験式は有機化学で、組成式は無機化学で用いられることが多い。1403 · イオン式一覧 プロ講師解説このページでは『イオン式一覧』について解説しています。 解説は高校化学・化学基礎を扱うウェブメディア『化学のグルメ』を通じて6年間大学受験に携わるプロの化学講師が執筆します。 · 高校 の化学で、 組成式の式量の一覧はこちら ・naclとグルコースの分子量・式量。その他組成式の式量一覧。 スポンサーリンク レクタングル(大)広告 水、水素、酸素、窒素などの分子量一覧まとめ 分子名 分子式(分子の化学式) 分子量;
組成式の書き方は、①陽イオン→陰イオン、②イオンの数の比、③比を右下に書く Na とCl を例に考えていきましょう。 順番に手順を考えていきましょう。このように、 構成イオンの種類とその数の割合を最も簡単な整数比で表したもの を 「組成式」 といいます。 この表し方を覚えておきましょう。 この授業の先生35 Cl- 37 Cl;
About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy & Safety How works Test new features水素 $$ h_2 $$ メタン「化学基礎 原子の構造と元素の周期表」,「構造式の楽な書き方」,「高校化学 化学結合の話(その2)」,「有機化合物 ちょっとまとめ」,「化学 炭化水素」,「 21(令和3年)大阪大3⃣構造決定Ⅰ、Ⅱ4⃣糖類Ⅰ、核酸Ⅱ」,「👑有機化学系統分離必勝




化学式 化学反応式 下敷き チャート式 数研オリジナルグッズ 数研出版 チャート式の数研出版




高校有機化学 脂肪族化合物の構造決定問題演習 受験の月
組成式を書くときにかっこを、どのようなときに書いたり、書かなかったりするんですか? 例 mg(oh)2 ai2(so4)3 na2co3 組成式 0 回答 ken 5年弱前 多原子イオンが複数ある時です。 1つ目の例 mg2 oh であれば、多原子イオンであるohが2つ必要なのでかっこがつきます。 2つ目の例 al337 Cl- 37 Cl; · 化学基礎第3回~分子式と組成式の違い~ 高校生 化学のノート Clear 表紙 1 2 公開日時 18年12月17日 23時50分 更新日時 年11月11日 時43分 高校生 全学年




高校化学基礎 単原子イオンと多原子イオン 映像授業のtry It トライイット
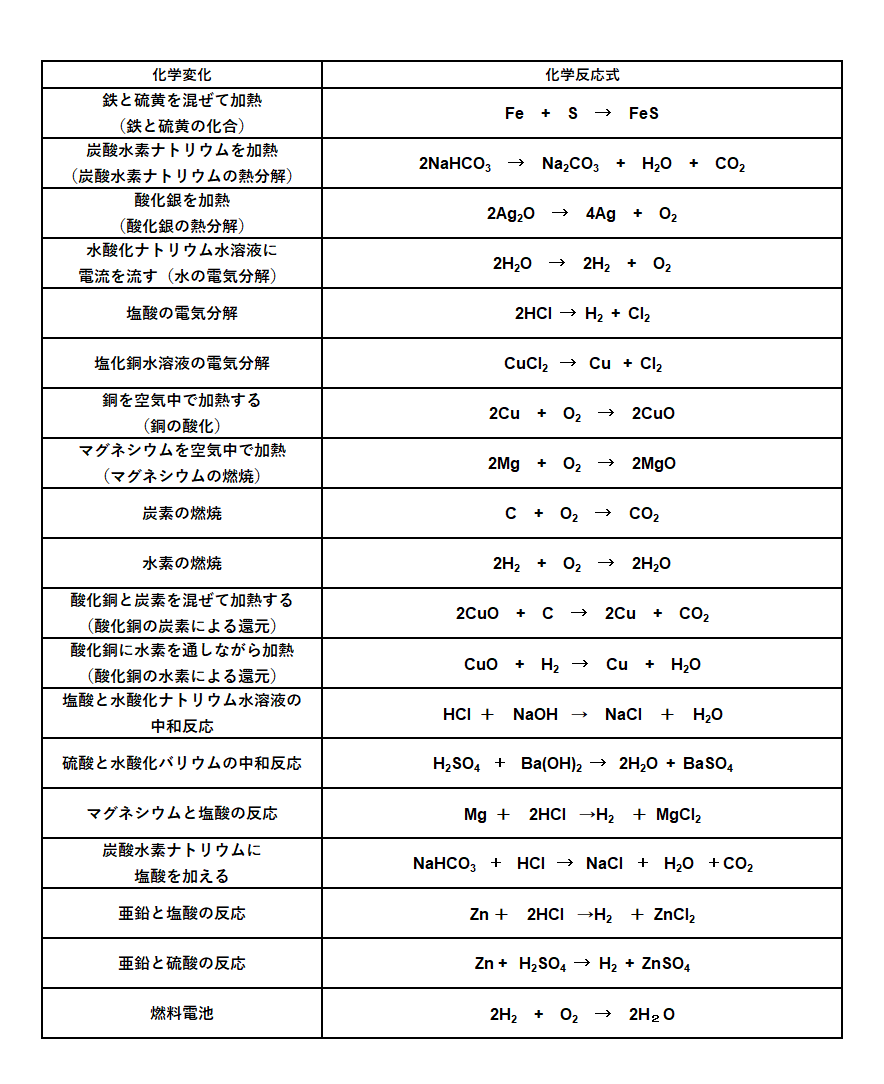



化学反応式まとめ 中学理科 ポイントまとめと整理
· 覚えなくていい? 高校化学の化学式一覧 21 分子式一覧 211 超基本的な有機物脂肪族の分子式と構造式; · 化学の組成式の意味がわかりません!!式の書き方もわからないし・・・。だれか、わかりやすく教えていただけませんか? !具体的に物質名を使ってくださると嬉しいです!!! 組成式は簡単に言うと、イオン結合している物質の成分元素の原子の数をもっとも簡単な整数比にして表したイオン結合の組成式についての解説です。 About Press Copyright Contact us Creators Advertise Developers Terms Privacy Policy & Safety How works Test new features © 21




1 2 1 イオン結晶と組成式 化学基礎 Youtube




日本石鹸洗剤工業会 石けん洗剤知識
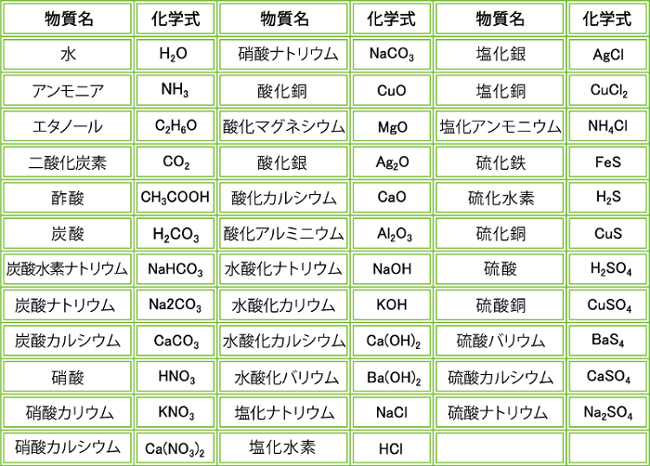
高校化学組成式一覧 PDF − 37 − 高校講座・学習メモ テレビ学習メモ 化学基礎 化学基礎監修・講師 小柳めぐみ 原子1個の質量は、非常に小さく、扱いにくい数値です。 化学 ニシジマ 高校化学分子結晶の沸点・黒鉛の電気伝導性を簡単に解説!高校化学選択をしている212 入試頻出の3大オキソ酸の化学式(分子式と構造式) 213 天然高分子の分子式と構造式;高校で学習する化学の内容のコラムをまとめています。 化学コラム 3.組成式 イオンからなる物質は、イオンの種類と割合を元素記号で示した組成式で表す。 例えば、塩化ナトリウム(ナトリウムイオンNaと塩化物イオンClからなる)の組成式はNaClとなる。また、塩化カルシウム




化学式とは コトバンク




イオン結合とイオン結晶
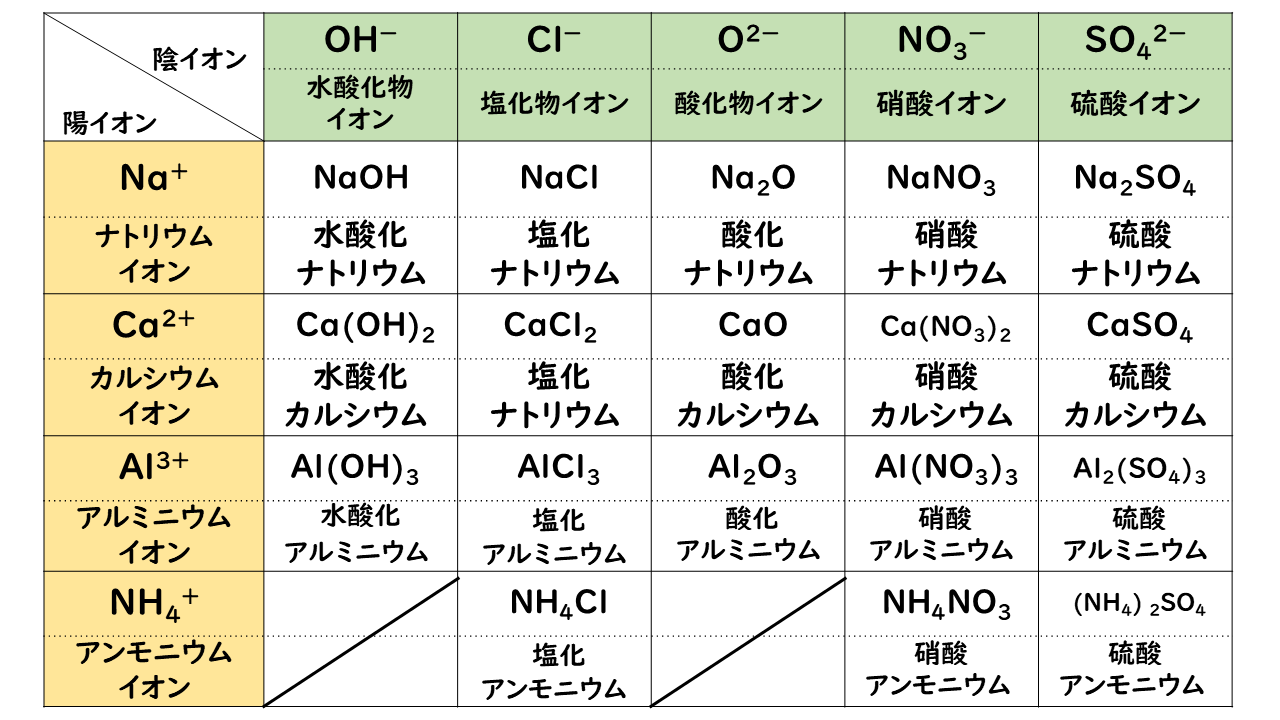
陽イオンの価数×陽イオンの数=陰イオンの価数×陰イオンの数 「Al3」と「SO4 2 」をくっつけてみましょう。 上記の公式を使うと 3×陽イオンの数=2×陰イオンの数 ですので 陽イオンの数=2、陰イオンの数=3となり「Al2(SO4)3」ができあがります。 ・ 高校化学 共有結合における結合エネルギーの特徴 ・ 共有結合とイオン結合の違い~共有結合の例~ 組成式基礎化学 INDEX へ戻る 原子 番号 元素 英語 記号 原子量 1 水素 Hydrogen H 1008 2 ヘリウム分子量 質量数の異なる原子(同位体)が存在しているため,原子が共有結合でつながってできた「分子」にも異なる質量のものがあります。例えば,塩素原子には 35 Clと 37 Clがあります。 そのため,塩素分子Cl 2 には 35 Cl- 35 Cl;




分子式 一覧 化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた




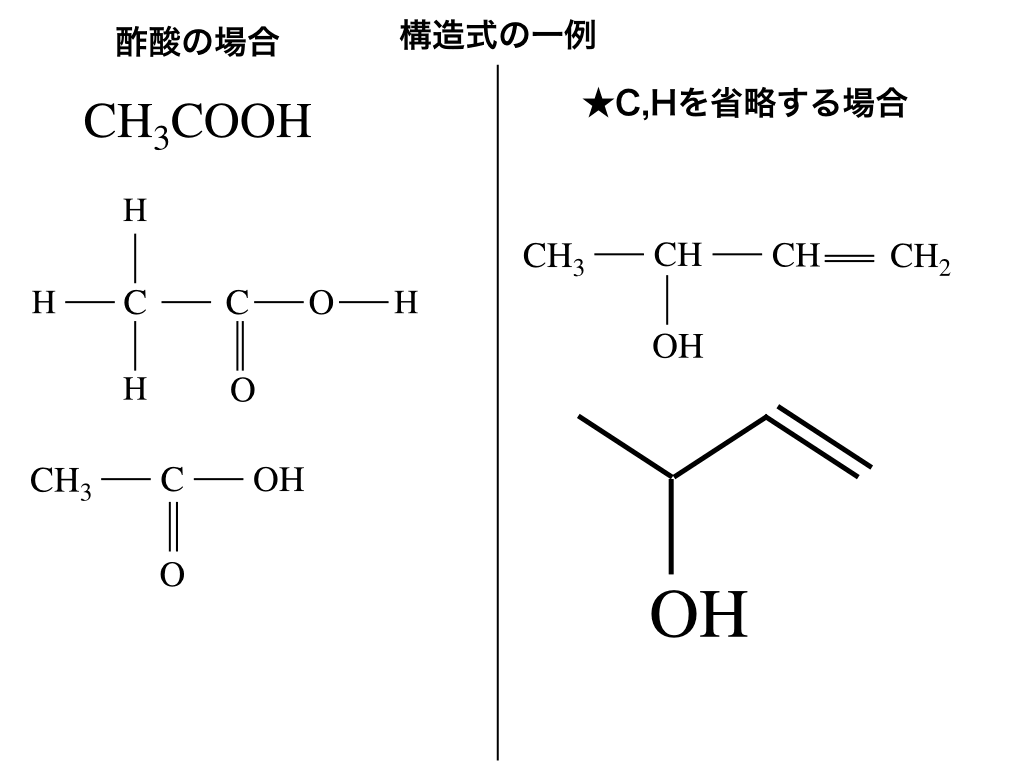
構造式の書き方 化学の基本として知っておきたいルールとは 高校生向け受験応援メディア 受験のミカタ
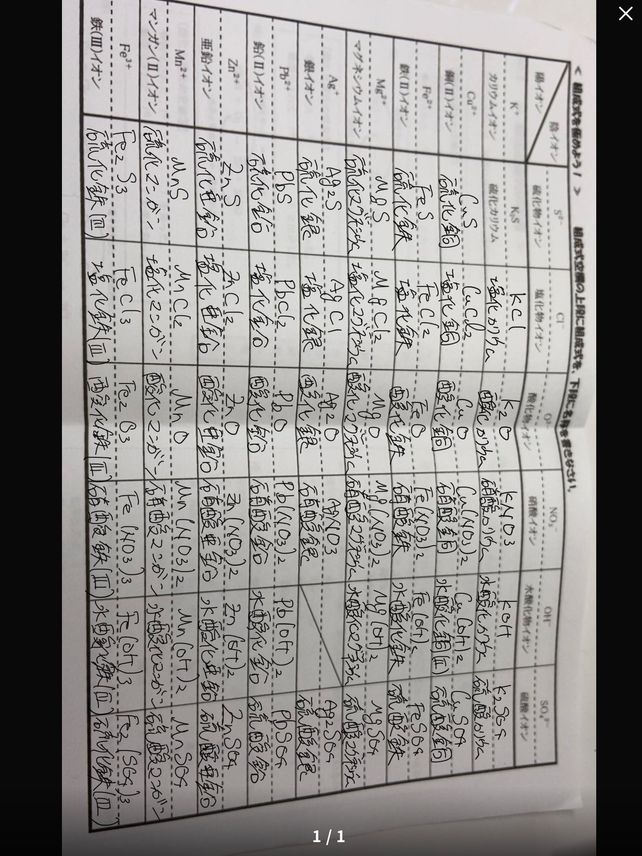
イオンを覚えていないと,多くの化合物や化学反応式を書くことができなくなってしまいます。 英単語を全く知らずに英文を書こうとするようなものです。 代表的なイオンを次に示しますので,確実に覚えておきましょう。 陽イオン(単原子イオン) 価数 イオン名 イオン式 1価 水素イオンはじめに ここでは、化学式について説明をします。 この化学式を理解すれば、やっとスタートラインに立てますのでしっかりと気を引き締めていきましょう! 化学式とは 化学式とは4つの式の総称のことです。 分子式、イオン式、組成式、そして構造式です。学習コンテンツ一覧 化学のグルメ 01 BASIC 高校「化学基礎」。 物質の構成や基礎化学計算、化学結合、酸・塩基、酸化・還元など超重要単元を解説しています。 詳しく見る 02 advance 高校「化学」。 気体や溶液、化学平衡、無機化学、有機化学の各
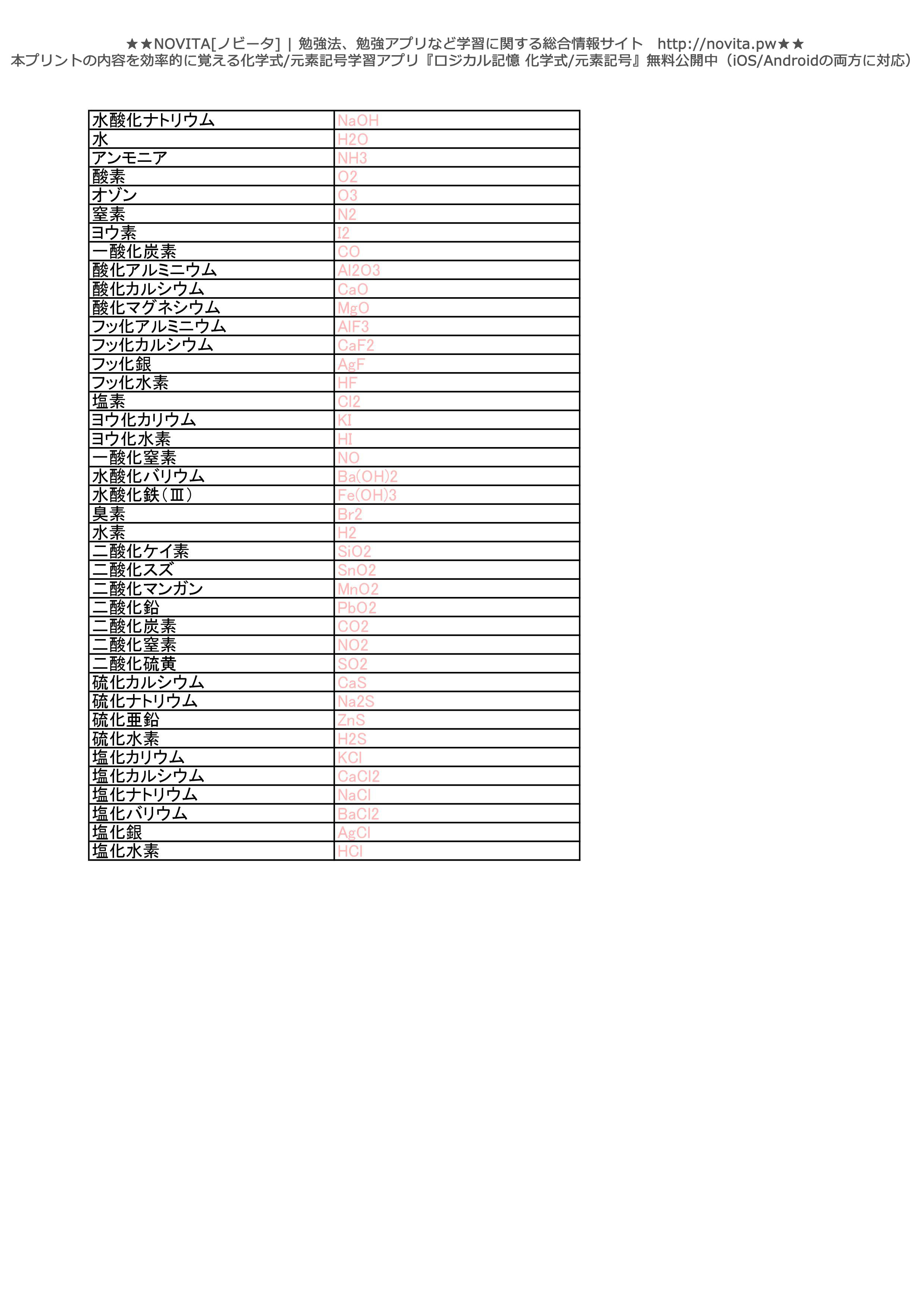



元素記号 化学式 勉強プリント Novita 勉強法



化学基礎の組成式について以下の表の添削をお願いします 間違いがも Yahoo 知恵袋
· 化学結合の一覧と結合の種類と強さを具体例で解説 共有結合、配位結合、イオン結合、金属結合、ファンデルワールス力、極性引力、水素結合、分子間力、クーロン力(静電気力)の違いを徹底解説します。 解説担当は、灘・甲陽在籍生100名を超え、東大学年 高校1年生, 単元 物質の構成, キーワード 組成式,高校1年生 化学基礎元素記号=組成式 原子量→式量 次の章では,銅の原子量を求める実験を紹介しましょう。高校生になって初めての化学実験ですね。お楽しみに。 それでは,この章の学習内容を確認しましょう。 1.原子量の規準になっている原子は何ですか? 2.二酸化炭素の分子量はいくらですね?ただし




高1 化学 高一 イオン 周期表など 高校生 化学のノート Clear




高校化学 組成式の作り方 Youtube
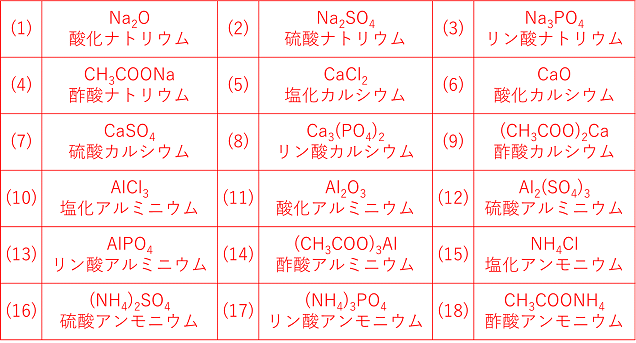
· 組成式とは? 物質を構成する原子と原子の数のもっとも簡単な比を表した式 これは、NaClのイオン結晶である岩塩です。 これは、NaとClがずっとイオン結合を連ねて、このような目に見える形になっているのです。 このように、無限にイオン結合が続いているわけですよ。 じゃあ、 分子式 みたいにその塊の原子の数を全部書き出したとします。 すると<その他の組成式> 炭酸水素ナトリウム NaHCO 3 硫酸水素ナトリウム NaHSO 4 亜硫酸水素ナトリウム NaHSO 3 酢酸ナトリウム CH 3 COONa 二酸化ケイ素 SiO 2




なぜ結合しないんですか 大至急お願いします Clear




高1 化学基礎 イオン 高校生 化学のノート Clear




危険物資格取得のための高校化学no 10 組成式 F M サイエンスブログ
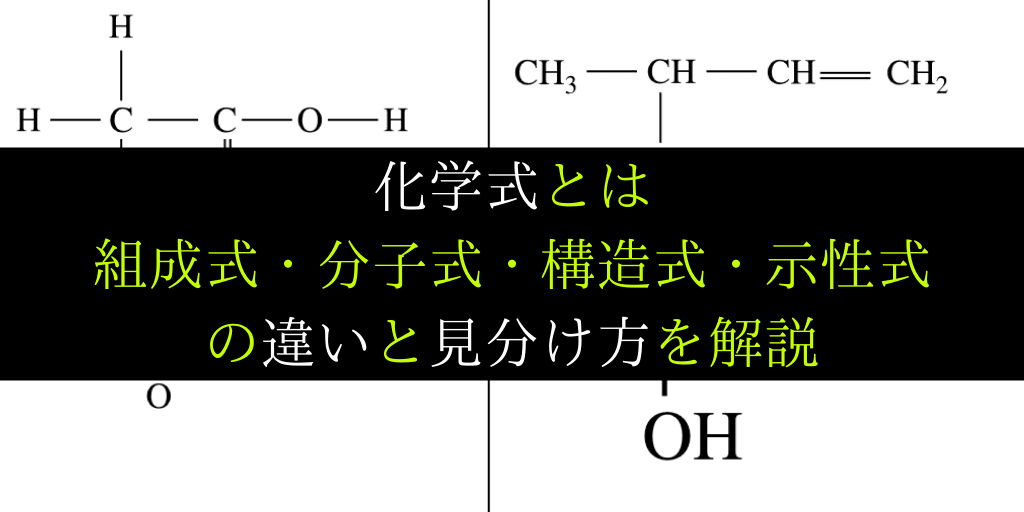



化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説




組成 式 一覧
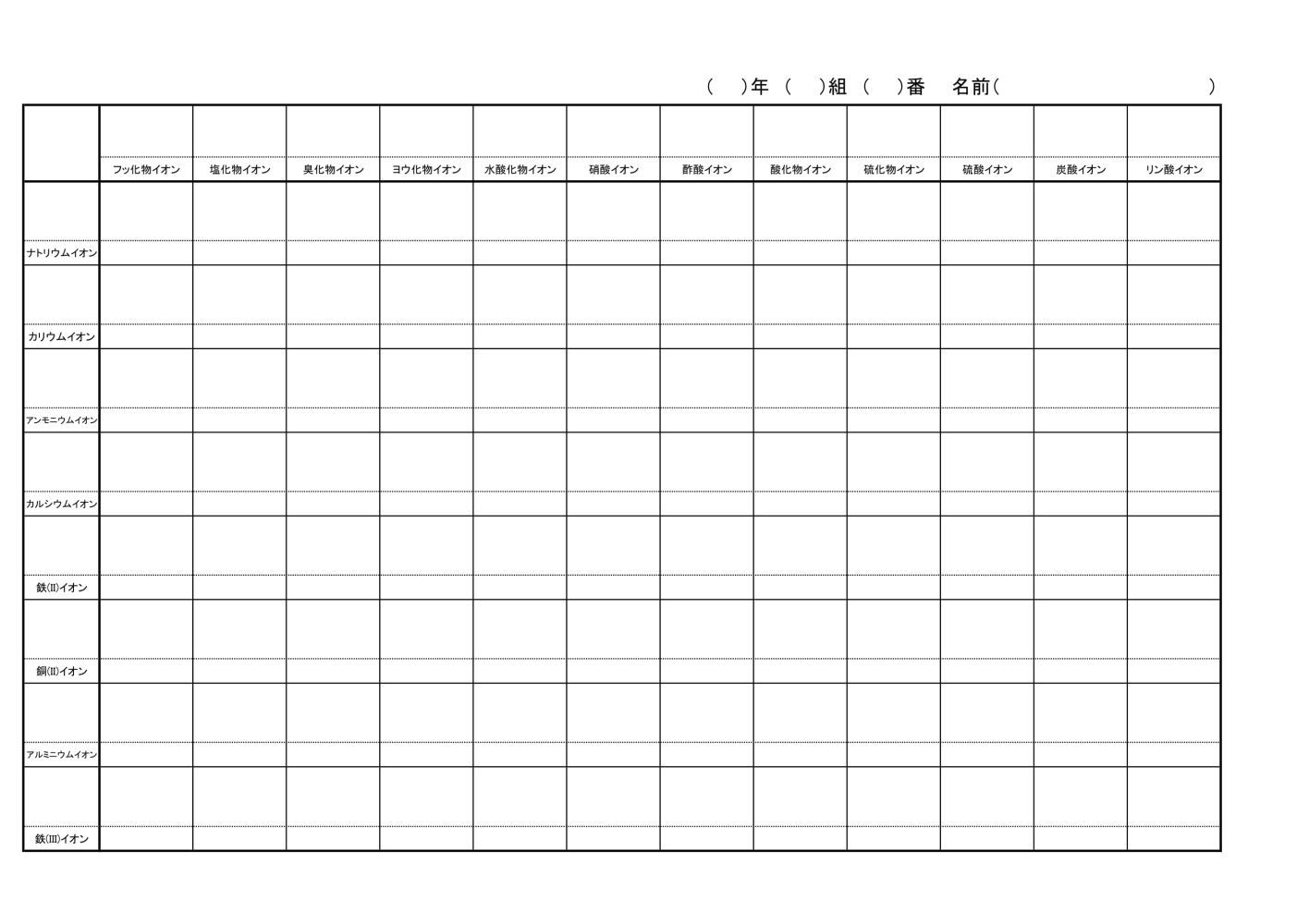



プリント とある化学教師でググって 楽天ブログ




硝酸 イオン イオン 式 褐色環反応




組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材




強酸と弱酸まとめ 見分け方 理系ラボ




覚えなければいけない有機化合物の名前と構造式の解答 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc
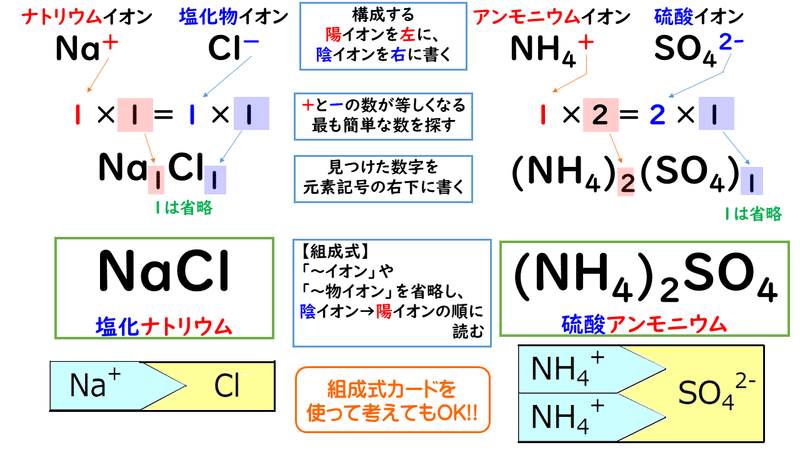



3 1 イオン結合とイオン結晶 おのれー Note



P56 62 H Left 2right Descubre Como Resolverlo En Qanda




メルカリ 化学基礎 教科書 セミナー 化学総合資料 教科書アドバイザー 高校 参考書 600 中古や未使用のフリマ




質問 化学 高校 組成式 化学式 分子式の違いはなんですか オンライン無料塾 ターンナップ



組成式の作り方について プラス マイナスのイオンの比で右上の数字が比 Yahoo 知恵袋



P56 62 H Left 2right Descubre Como Resolverlo En Qanda




化学基礎 暗記まとめ 高校生 化学のノート Clear




セ対 これだけは覚える 化学式一覧 高校生 化学のノート Clear



トップ 100 マグネシウム 化学式 すべての鉱山クラフトのアイデア




高校化学 結合 イオン結合 組成式の書き方 オンライン無料塾 ターンナップ Youtube




ボード 解剖学 のピン




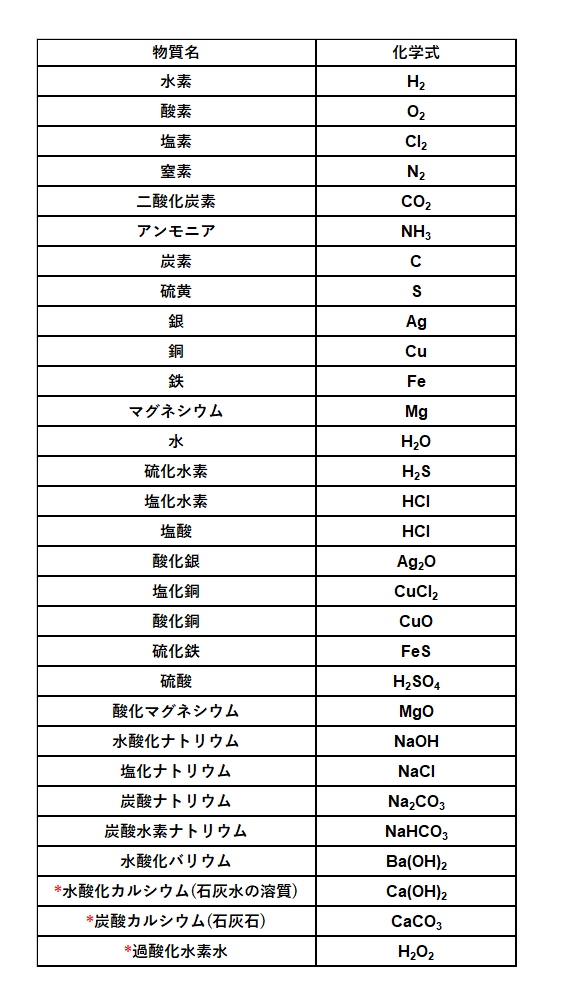
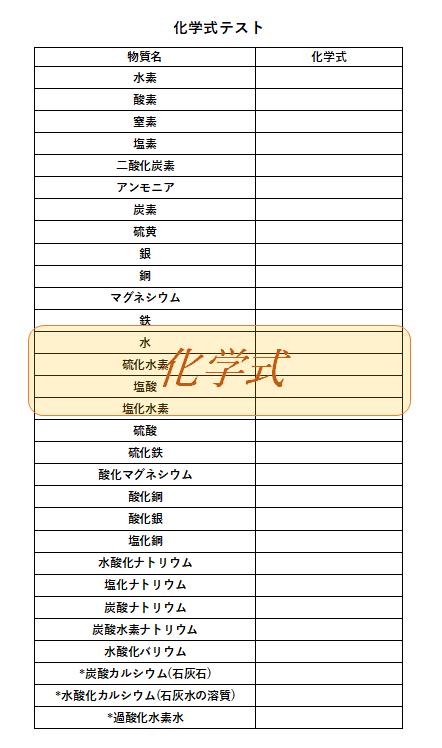
化学式 一覧




中2 元素記号 化学式 これだけ覚えれば大丈夫 個別指導塾ノーバス北浦和本校



硫酸水素マグネシウム You Iggy



化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説



化学 式 種類 無料の結婚式の画像



酸化還元反応を解説 酸化数を理解して半反応式を覚えよう Studyplus スタディプラス



化学式記号 Tourotom1 1



化学式とは その意味から大学受験に役立つ化学反応式の覚え方まで Studyplus スタディプラス




反応熱の問題で 自分で解いてみたら答えは合っていたのですが 解答と式が違っていました Clear




メルカリ 化学基礎 教科書 参考書 300 中古や未使用のフリマ




覚えなければいけない有機化合物の名前と構造式の解答 数学 化学講師 佐藤学による受験生に役立つ濃縮ポイントと Etc



Gy9pdlbxkpbrzm




理科 中2 7 化学反応式の作り方 Youtube



リン酸銅 Ii You Iggy




高校化学 構造式 映像授業のtry It トライイット



組成式 Japaneseclass Jp




どうして カルシウムイオン Ca2 と硫酸イオン So42 との組成式がcaso Clear




化学式 組成式 分子式 示性式 構造式の違いと見分け方を具体例で解説




高校有機化学 有機化合物 炭化水素 の名称と命名規則まとめ 受験の月




イオン式 電離式まとめ 中学理科 ポイントまとめと整理



化学の組成式で 不定期に2とか3がついたり がついたり どうい Yahoo 知恵袋




高1 化学基礎 1 これだけは覚えておきたいイオン式 組成式 高校生 Clear




化学式 プロシードネットショップ本店




化学式とは 受験化学で覚えておくべき化学式を一覧にまとめてみた 化学受験テクニック塾



5 3 Lihat Cara Penyelesaian Di Qanda



化学基礎の組成式なんですけど あってますか 赤と黒の違いは気 Yahoo 知恵袋




化学式 一覧




高校化学 ファンデルワールス力 充填率 組成式と分子式を簡単に解説 高校化学選択をしている受験生や高校生は必見 弁理士を目指すブログ




どうして水酸化銅 Ii のohにカッコがついて Oh になるんですか カッ 高校 教えて Goo



分子式 一覧 電離式の一覧 中学生用




高校有機化学 成分元素の検出と元素分析 組成式の決定2パターン 受験の月




高校化学基礎 組成式 練習編 映像授業のtry It トライイット




Lihat Cara Penyelesaian Di Qanda



金と銀とクリスタルの化学組成式や元素記号を教えて下さい 金 Au銀 Yahoo 知恵袋




高校有機化学 有機化合物の表現 構造式 示性式 分子式 組成式 と代表的な官能基まとめ 受験の月



酸化銀 I Iii You Iggy



組成 式 一覧 ガラスの種類と組成 ガラスの基礎知識 国内大手加工ガラスメーカーのガラス情報専門サイト 三芝硝材



高校化学のイオンの問題で 陽イオンと陰イオンの組み合わせができる Yahoo 知恵袋




高校の化学についてです 二分子のシクロデキストリンの中にフラーレ 化学 教えて Goo



塩化 カルシウム 化学式



山崎高校 化学 授業支援システム



イオン式の覚え方みたいなのってありますか これ全て覚えたいのですが Yahoo 知恵袋




高校化学基礎 組成式の書き方 映像授業のtry It トライイット
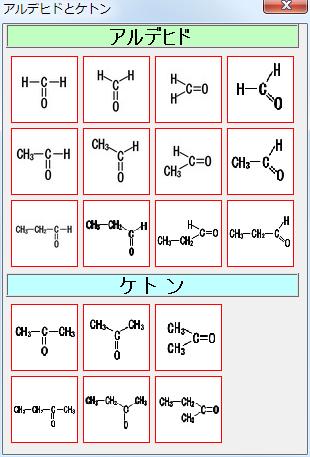



Microsoft Word Chemformbook Docx Pdf 無料ダウンロード
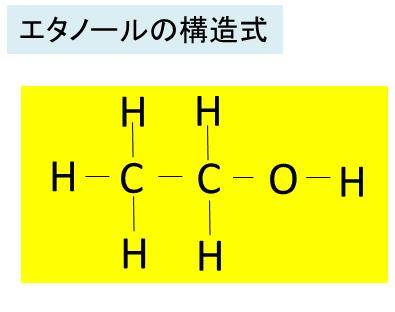



エタノール C2h5oh の化学式 分子式 構造式 電子式 示性式 イオン式 分子量は 代表的な反応式は




P0rt 42 1 Ch3coo Po4 Descubre Como Resolverlo En Qanda



トップ 100 組成式 一覧 すべての鉱山クラフトのアイデア




組成 式 一覧 元素 化合物の種類と化学式の一覧




化学式 Wikipedia




分子式 と 組成 式 の 違い 高校化学 分子式と組成式の違いと見分け方 書き方 覚え方 求め方



高校入試の理科に出やすい問題 化学式編 個別指導学習塾開成館アカデミー桂川




高校化学 元素分析と組成式 映像授業のtry It トライイット




イオン結合でできるイオン結晶を表す組成式って何



物質の構造と構成 の記事一覧 2 4ページ目



理科総合
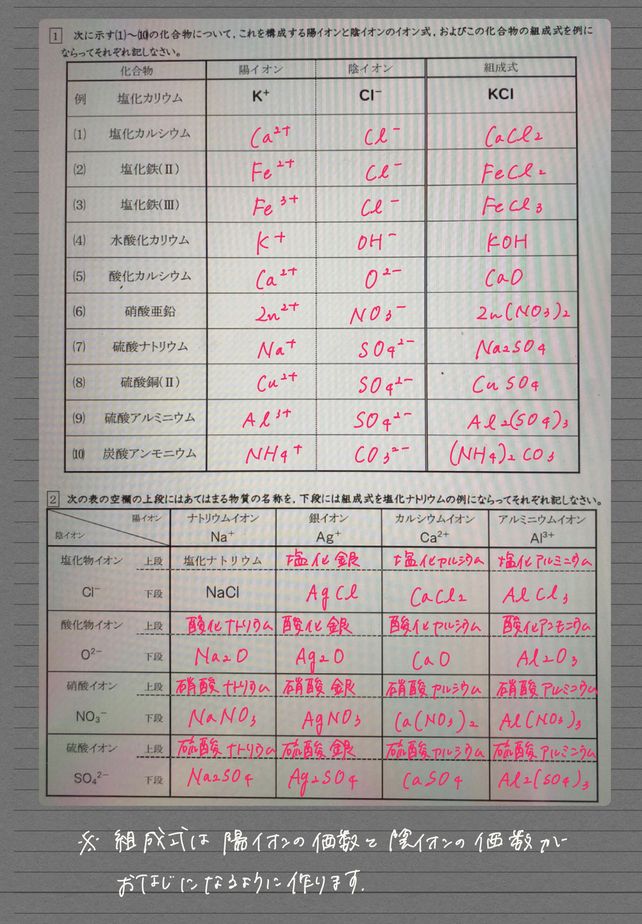



1 1 10 K C1 Kc1 Ii Descubre Como Resolverlo En Qanda




化学式 一覧




組成式とは 分子式との違いも解説 一覧表つき 高校生向け受験応援メディア 受験のミカタ
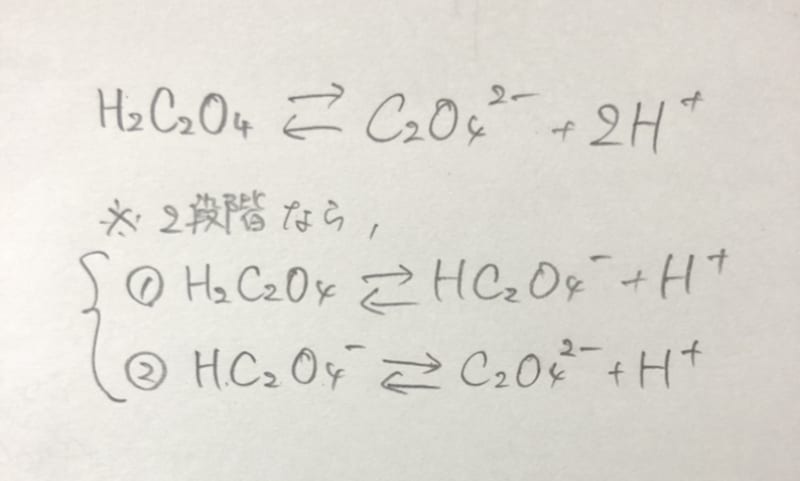



シュウ酸の電離式を教えてください アンサーズ




イオン式 電離式まとめ 中学理科 ポイントまとめと整理




イオンの組成式についてなんですけど 右下の硫酸アルミニウムで なぜ3 2 2 3にな Clear




化学式 一覧



理科4ページ目 三重の個人契約家庭教師




イオン反応式 Japaneseclass Jp



0 件のコメント:
コメントを投稿